![]() FØLGE EFTER
FØLGE EFTER
En ny innovativ teknik udviklet af et videnskabeligt hold ved Center for Genomic Regulation (CRG) i Barcelona har opdaget eksistensen af et væld af 'fjernkontroller', der styrer proteinernes funktion, og som kan bruges som mål for at opnå mere effektive lægemidler og effektiv i forskellige patologier såsom demens, cancer og smitsomme infektioner.
Disse 'fjernbetjeninger' er videnskabeligt kendt som allosteriske steder. Det er fjernbetjeninger, der er fjernt fra det sted, hvor proteinet virker, men som har kapacitet til at regulere eller modulere det", Júlia Domingo, første medforfatter af undersøgelsen, som er offentliggjort i onsdags i tidsskriftet "Nature", forklaret til ABC. Og han tilføjer en lignelse: "Det er, som om man med den fjernbetjening kunne tænde og slukke for pæren eller regulere lysets intensitet."
I dette tilfælde, hvor den har til hensigt at blokere eller regulere aktiviteten af proteiner, der opretholder deres ændrede funktion i indespærring. I tilfælde af kræft får de proteiner, der har fået en mutation, deres funktionalitet ændret, de gør det unormalt, og cellen vokser usædvanligt. I mange tilfælde er der ingen lægemidler, der kan modulere eller blokere denne unormale aktivitet, eller hvis der er, er de ikke specifikke og frigives også fra andre proteiner, der fungerer normalt.
Traditionelt har stofjægere designet behandlinger, der retter sig mod det aktive sted af et protein, hvis lille region producerer kemiske reaktioner, hvor mål bindes. Ulempen ved disse lægemidler, kendt som ortosteriske lægemidler, er, at de aktive steder i mange proteiner er meget ens, og lægemidlerne har bundet og hæmmet mange forskellige proteiner på samme tid, selv dem der fungerer normalt og ikke er interessante at røre ved, hvilket kan give bivirkninger.
"Der kom han ind i begrebet allosteri og det potentiale, det har for at designe lægemidler. Det interessante ved allosteriske steder er, at de er superspecifikke for hvert protein. Hvis disse allosteriske steder finder en del af proteinoverfladen, hvor lægemidlet kan lande, vil det være ekstremt specifikt for det protein. Vi vil kunne stræbe efter mere effektiv medicin”, påpeger forskeren.
"Vi finder ikke kun, at disse terapeutiske steder er rigelige, men der er beviser for, at de kan manipuleres på mange forskellige måder. I stedet for bare at tænde og slukke for dem, kan vi modulere deres aktivitet som en termostat. Fra et ingeniørmæssigt synspunkt er det, som om vi har ramt guld, for det giver os en masse plads til at designe 'smart drugs', der går til det onde og springer det gode over”, forklarer André Faure, postdoktor ved CRG. og første medforfatter til artiklen.
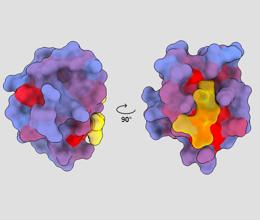 tredimensionelt billede, der viser det humane protein PSD95-PDZ3 fra forskellige synsvinkler. Et molekyle er vist binding til det aktive sted i gult. Blå til rød farvegradient indikerer mulige allosteriske steder – André Faure/ChimeraX
tredimensionelt billede, der viser det humane protein PSD95-PDZ3 fra forskellige synsvinkler. Et molekyle er vist binding til det aktive sted i gult. Blå til rød farvegradient indikerer mulige allosteriske steder – André Faure/ChimeraX
Til denne opdagelse har holdet brugt en metode, der giver dem mulighed for at tage et protein og en systemisk form og et globalt møde med alle stederne. For at gøre dette har de valgt to meget rigelige proteiner i vores menneskelige proteom. "50% af proteinoverfladen har allosterisk potentiale. Vores metode gør det muligt at lave et atlas over allosteriske steder, hvilket ville gøre processen med at søge efter effektive lægemidler meget mere effektiv”, forsikrer Júlia Domingo.
Undersøgelsens forfattere udviklede en teknik kaldet double-depth PCA (ddPCA), som de beskriver som et "brute force eksperiment." "Vi bryder ting med vilje på tusindvis af forskellige måder for at danne et komplet billede af, hvordan noget fungerer," forklarer ICREA forskningsprofessor Ben Lehner, koordinator for System Biology-programmet ved CRG og forfatter til undersøgelsen. ”Det er ligesom hvis man har mistanke om, at et tændrør er dårligt, men i stedet for bare at tjekke det, vil mekanikeren skille hele bilen ad og tjekke alle delene én efter én. Ved at analysere ti tusinde ting på én gang identificerer vi alle de brikker, der er virkelig vigtige."
Dernæst bruger vi kunstig intelligens-algoritmer til at fortolke laboratorieresultaterne.
En af de store fordele ved metoden, udover at forenkle processen, der er nødvendig for at finde allosteriske steder, er, at det er en overkommelig og tilgængelig teknik for ethvert forskningslaboratorium i verden. »Det kræver blot adgang til grundlæggende molekylærbiologiske reagenser, adgang til en DNA-sequencer og en computer. Med disse tre komponenter kan ethvert laboratorium på 2-3 måneder, med et lille budget, udføre dette eksperiment på det protein af interesse, de ønsker”, forsikrer Júlia Domingo. Forskernes håb er, at vores forskere vil bruge teknikken til hurtigt og omfattende at kortlægge de allosteriske steder af menneskelige proteiner én efter én. "Hvis vi har nok data, kan vi måske en dag gå et skridt videre og forudsige fra proteinsekvens til funktion. Brug disse data til at vejlede dem som bedre terapier til at forudsige, om en bestemt ændring i et protein vil degenerere til en sygdom”, konkluderede forskeren.