![]() FØLG
FØLG
En ny innovativ teknikk utviklet av et vitenskapelig team ved Center for Genomic Regulation (CRG) i Barcelona har oppdaget eksistensen av en mengde "fjernkontroller" som kontrollerer funksjonen til proteiner og som kan brukes som mål for å oppnå mer effektive medisiner og effektiv i ulike patologier som demens, kreft og smittsomme infeksjoner.
Disse "fjernkontrollene" er vitenskapelig kjent som allosteriske nettsteder. Dette er fjernkontroller som er fjernt fra virkestedet til proteinet, men som har kapasitet til å regulere eller modulere det», Júlia Domingo, første medforfatter av studien, som publiseres denne onsdagen i tidsskriftet «Nature». forklart til ABC. Og han legger til en liknelse: "Det er som om du med den fjernkontrollen kunne slå lyspæren av og på eller regulere lysstyrken."
I dette tilfellet hvor den har til hensikt å blokkere eller regulere aktiviteten til proteiner som opprettholder deres endrede funksjon i innesperring. For eksempel, når det gjelder kreft, får proteinene som har ervervet en mutasjon sin funksjonalitet endret, de gjør det unormalt og cellen vokser på en uvanlig måte. I mange tilfeller er det ingen medisiner som kan modulere eller blokkere denne unormale aktiviteten, eller hvis det er, er de ikke spesifikke og frigjøres også fra andre proteiner som fungerer normalt.
Tradisjonelt har narkotikajegere utviklet behandlinger som retter seg mot det aktive stedet til et protein, hvis lille region produserer kjemiske reaksjoner der mål bindes. Ulempen med disse medikamentene, kjent som ortosteriske legemidler, er at de aktive stedene til mange proteiner er svært like og legemidlene har bundet og hemmet mange forskjellige proteiner samtidig, selv de som fungerer normalt og ikke er interessante å ta på, som kan gi bivirkninger.
"Der kom han inn på konseptet allosteri og potensialet det har for å designe legemidler. Det interessante med allosteriske nettsteder er at de er superspesifikke for hvert protein. Hvis disse allosteriske stedene finner en del av proteinoverflaten der stoffet kan lande, vil det være ekstremt spesifikt for det proteinet. Vi vil kunne strebe etter mer effektive medisiner, påpeker forskeren.
"Ikke bare finner vi at disse terapeutiske stedene er rikelig, men det er bevis på at de kan manipuleres på mange forskjellige måter. I stedet for å bare slå dem av og på, kan vi modulere aktiviteten deres som en termostat. Fra et ingeniørmessig synspunkt er det som om vi har truffet gull, fordi det gir oss mye rom til å designe «smarte medisiner» som går til det dårlige og hopper over det gode», forklarer André Faure, postdoktor ved CRG og første medforfatter av artikkelen.
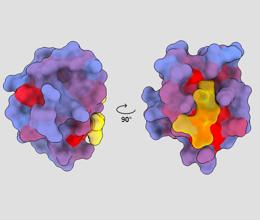 tredimensjonalt bilde som viser det humane proteinet PSD95-PDZ3 fra forskjellige synsvinkler. Et molekyl er vist å binde seg til det aktive stedet i gult. Blå til rød fargegradient indikerer mulige allosteriske steder – André Faure/ChimeraX
tredimensjonalt bilde som viser det humane proteinet PSD95-PDZ3 fra forskjellige synsvinkler. Et molekyl er vist å binde seg til det aktive stedet i gult. Blå til rød fargegradient indikerer mulige allosteriske steder – André Faure/ChimeraX
For denne oppdagelsen har teamet brukt en metode som lar dem ta et protein og en systemisk form og et globalt møte med alle nettstedene. For å gjøre dette har de valgt ut to svært rikelige proteiner i vårt menneskelige proteom. «50 % av proteinoverflaten har allosterisk potensial. Metoden vår gjør det mulig å lage et atlas over allosteriske steder, noe som vil gjøre prosessen med å søke etter effektive medisiner mye mer effektiv”, forsikrer Júlia Domingo.
Studieforfatterne utviklet en teknikk kalt double-depth PCA (ddPCA), som de beskriver som et "brute force eksperiment." "Vi bryter ting med vilje på tusenvis av forskjellige måter for å danne et fullstendig bilde av hvordan noe fungerer," forklarer ICREA forskningsprofessor Ben Lehner, koordinator for systembiologiprogrammet ved CRG og forfatter av studien. «Det er som om du mistenker at en tennplugg er dårlig, men i stedet for bare å sjekke det, vil mekanikeren ta hele bilen fra hverandre og sjekke alle delene én etter én. Ved å analysere ti tusen ting på en gang identifiserer vi alle brikkene som er virkelig viktige.»
Deretter bruker vi kunstig intelligens-algoritmer for å tolke laboratorieresultatene.
En av de store fordelene med metoden, i tillegg til å forenkle prosessen som er nødvendig for å finne allosteriske steder, er at det er en rimelig og tilgjengelig teknikk for ethvert forskningslaboratorium i verden. "Det krever bare tilgang til grunnleggende molekylærbiologiske reagenser, tilgang til en DNA-sekvenser og en datamaskin. Med disse tre komponentene kan ethvert laboratorium i løpet av 2-3 måneder, med et lite budsjett, utføre dette eksperimentet på proteinet av interesse de vil ha”, forsikrer Júlia Domingo. Forskernes håp er at forskerne våre vil bruke teknikken til raskt og omfattende å kartlegge de allosteriske stedene til menneskelige proteiner én etter én. "Hvis vi har nok data, kan vi kanskje en dag gå et skritt videre og forutsi fra proteinsekvens til funksjon. Bruk disse dataene til å veilede dem som bedre terapier for å forutsi om en viss endring i et protein kommer til å degenerere til en sykdom”, konkluderte forskeren.
