![]() NÁSLEDOVAT
NÁSLEDOVAT
Nová inovativní technika vyvinutá vědeckým týmem z Centra pro genomickou regulaci (CRG) v Barceloně objevila existenci velkého množství „dálkových kontrol“, které řídí funkci proteinů a které lze použít jako cíle k dosažení účinnějších léků. a účinný při různých patologiích, jako je demence, rakovina a infekční infekce.
Tyto „dálkové ovladače“ jsou vědecky známé jako alosterická místa. Jedná se o dálkové ovladače, které jsou vzdálené od místa působení proteinu, ale mají kapacitu jej regulovat nebo modulovat“, Júlia Domingo, první spoluautorka studie, která vychází tuto středu v časopise „Nature“, vysvětlil ABC. A dodává přirovnání: "Jako byste tím dálkovým ovladačem mohli rozsvěcovat a zhasínat žárovku nebo regulovat intenzitu světla."
V tomto případě, kdy má v úmyslu blokovat nebo regulovat aktivitu proteinů, které si udržují svou změněnou funkci v omezení. Například v případě rakoviny mají proteiny, které získaly mutaci, změněnou funkčnost, dělají to abnormálně a buňka neobvykle roste. V mnoha případech neexistují žádné léky, které by mohly modulovat nebo blokovat tuto abnormální aktivitu, nebo pokud existují, nejsou specifické a jsou také uvolňovány z jiných proteinů, které fungují normálně.
Tradičně lovci drog navrhovali léčby, které se zaměřují na aktivní místo proteinu, jehož malá oblast produkuje chemické reakce, kde se cíle vážou. Nevýhodou těchto léků, známých jako ortosterické léky, je to, že aktivní místa mnoha proteinů jsou velmi podobná a léky navázaly a inhibovaly mnoho různých proteinů současně, dokonce i ty, které fungují normálně a nejsou zajímavé na dotek, což může způsobit nežádoucí účinky.
„Tam vstoupil do konceptu alosterie a potenciálu, který má při navrhování léků. Zajímavá věc na alosterických místech je, že jsou super specifické pro každý protein. Pokud tato alosterická místa najdou část povrchu proteinu, kde může lék přistát, bude pro tento protein extrémně specifický. Budeme moci usilovat o účinnější léky,“ zdůrazňuje výzkumník.
„Nejenže zjišťujeme, že tato terapeutická místa jsou hojná, ale existují důkazy, že s nimi lze manipulovat mnoha různými způsoby. Místo toho, abychom je pouze zapínali a vypínali, můžeme modulovat jejich činnost jako termostat. Z technického hlediska je to, jako bychom narazili na zlato, protože nám to dává velký prostor navrhnout „chytré drogy“, které jdou do špatného a přeskakují dobré,“ vysvětluje André Faure, postdoktorandský výzkumný pracovník CRG. a prvním spoluautorem článku.
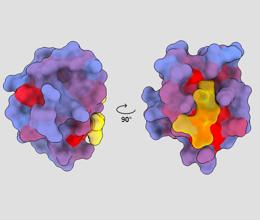 trojrozměrný obrázek zobrazující lidský protein PSD95-PDZ3 z různých úhlů pohledu. Molekula se váže na aktivní místo žlutě. Modrý až červený barevný gradient označuje možná alosterická místa – André Faure/ChimeraX
trojrozměrný obrázek zobrazující lidský protein PSD95-PDZ3 z různých úhlů pohledu. Molekula se váže na aktivní místo žlutě. Modrý až červený barevný gradient označuje možná alosterická místa – André Faure/ChimeraX
K tomuto objevu tým použil metodu, která jim umožňuje přijmout protein a systémovou formu a globální setkání se všemi místy. K tomu si vybrali dva velmi hojné proteiny v našem lidském proteomu. „50 % povrchu proteinu má alosterický potenciál. Naše metoda umožňuje vytvořit atlas alosterických lokalit, což by proces hledání účinných léků výrazně zefektivnilo,“ ujišťuje Júlia Domingo.
Autoři studie vyvinuli techniku zvanou double-depth PCA (ddPCA), kterou popisují jako „experiment hrubé síly“. "Úmyslně rozbíjíme věci tisíci různými způsoby, abychom si vytvořili úplný obrázek o tom, jak něco funguje," vysvětluje profesor výzkumu ICREA Ben Lehner, koordinátor programu systémové biologie v CRG a autor studie. „Je to jako když máte podezření, že zapalovací svíčka je špatná, ale místo toho, aby to jen kontroloval, mechanik rozebere celé auto a zkontroluje všechny díly jednu po druhé. Analýzou deseti tisíc věcí najednou identifikujeme všechny části, které jsou opravdu důležité.“
Dále používáme algoritmy umělé inteligence k interpretaci laboratorních výsledků.
Jednou z velkých výhod metody, kromě zjednodušení procesu nezbytného k nalezení alosterických míst, je to, že jde o dostupnou a dostupnou techniku pro jakoukoli výzkumnou laboratoř na světě. "Vyžaduje to pouze přístup k základním molekulárním biologickým činidlům, přístup k sekvenátoru DNA a počítači. S těmito třemi složkami může jakákoli laboratoř za 2-3 měsíce s malým rozpočtem provést tento experiment s požadovaným proteinem,“ ujišťuje Júlia Domingo. Vědci doufají, že naši vědci tuto techniku využijí k rychlému a komplexnímu zmapování alosterických míst lidských proteinů jedno po druhém. "Pokud budeme mít dostatek dat, možná jednoho dne budeme moci jít o krok dále a předpovídat od proteinové sekvence až po funkci." Použijte tato data, abyste je vedli jako lepší terapie k předpovědi, zda se určitá změna v proteinu zvrhne v nemoc,“ uzavřel výzkumník.
