![]() يتلي
يتلي
اكتشفت تقنية مبتكرة جديدة طورها فريق علمي في مركز تنظيم الجينوم (CRG) في برشلونة وجود العديد من "أجهزة التحكم عن بعد" التي تتحكم في وظيفة البروتينات ويمكن استخدامها كأهداف لتحقيق عقاقير أكثر فعالية. وفعال في أمراض مختلفة مثل الخرف والسرطان والالتهابات المعدية.
تُعرف "أجهزة التحكم عن بُعد" هذه علميًا باسم المواقع الخيفية. هذه أجهزة تحكم عن بعد بعيدة عن موقع عمل البروتين ، ولكن لديها القدرة على تنظيمه أو تعديله "، جوليا دومينغو ، المؤلف المشارك الأول للدراسة ، التي نُشرت يوم الأربعاء في مجلة" Nature "، أوضح لـ ABC. ويضيف تشبيهًا: "يبدو الأمر كما لو أنه باستخدام جهاز التحكم عن بعد هذا ، يمكنك تشغيل المصباح الكهربائي وإيقافه أو تنظيم شدة الضوء."
في هذه الحالة حيث ينوي منع أو تنظيم نشاط البروتينات التي تحافظ على وظيفتها المتغيرة في الحبس. على سبيل المثال ، في حالة السرطان ، تتغير وظائف البروتينات التي اكتسبت طفرة ، وهي تفعل ذلك بشكل غير طبيعي وتنمو الخلية بطريقة غير عادية. في كثير من الحالات ، لا توجد أدوية يمكنها تعديل أو منع هذا النشاط غير الطبيعي أو ، إذا كان هناك ، فهي ليست محددة ويتم إطلاقها أيضًا من البروتينات الأخرى التي تعمل بشكل طبيعي.
تقليديا ، صمم صائدو الأدوية علاجات تستهدف الموقع النشط للبروتين ، الذي تنتج منطقته الصغيرة تفاعلات كيميائية حيث تلتصق الأهداف. عيب هذه الأدوية ، المعروفة باسم الأدوية التقويمية ، هو أن المواقع النشطة للعديد من البروتينات متشابهة جدًا وأن الأدوية قد ربطت وتثبط العديد من البروتينات المختلفة في نفس الوقت ، حتى تلك التي تعمل بشكل طبيعي وليس من المثير للاهتمام لمسها ، والتي يمكن أن يسبب آثارا جانبية.
"هناك دخل في مفهوم allosteria وإمكانية تصميم الأدوية. الشيء المثير للاهتمام حول مواقع allosteric هو أنها خاصة جدًا لكل بروتين. إذا وجدت هذه المواقع الخيفية جزءًا من سطح البروتين حيث يمكن أن يهبط الدواء ، فسيكون محددًا للغاية لهذا البروتين. وأشار الباحث إلى أننا سنكون قادرين على التطلع إلى أدوية أكثر فاعلية.
"لا نجد فقط أن هذه المواقع العلاجية وفيرة ، ولكن هناك أدلة على أنه يمكن التلاعب بها بعدة طرق مختلفة. بدلاً من مجرد تشغيلها وإيقافها ، يمكننا تعديل نشاطها مثل منظم الحرارة. من وجهة نظر هندسية ، يبدو الأمر كما لو أننا توصلنا إلى الذهب ، لأنه يمنحنا مساحة كبيرة لتصميم "عقاقير ذكية" تذهب إلى الأمور السيئة وتتخطى الجيد "، كما يوضح André Faure ، باحث ما بعد الدكتوراه في CRG وأول مؤلف مشارك للمقال.
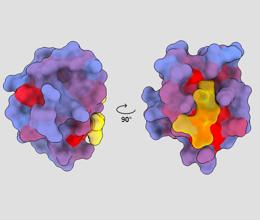 صورة ثلاثية الأبعاد توضح البروتين البشري PSD95-PDZ3 من وجهات نظر مختلفة. يظهر جزيء مرتبط بالموقع النشط باللون الأصفر. يشير التدرج اللوني من الأزرق إلى الأحمر إلى المواقع الخلافية المحتملة - André Faure / ChimeraX
صورة ثلاثية الأبعاد توضح البروتين البشري PSD95-PDZ3 من وجهات نظر مختلفة. يظهر جزيء مرتبط بالموقع النشط باللون الأصفر. يشير التدرج اللوني من الأزرق إلى الأحمر إلى المواقع الخلافية المحتملة - André Faure / ChimeraX
من أجل هذا الاكتشاف ، استخدم الفريق طريقة تسمح لهم بأخذ بروتين وشكل جهازي ولقاء عالمي مع جميع المواقع. للقيام بذلك ، اختاروا نوعين من البروتينات بكثرة في بروتين الإنسان. 50٪ من سطح البروتين لديه قدرة خيفية. طريقتنا تجعل من الممكن عمل أطلس للمواقع الخيفية ، مما يجعل عملية البحث عن الأدوية الفعالة أكثر كفاءة "، تؤكد جوليا دومينغو.
طور مؤلفو الدراسة تقنية تسمى PCA مزدوج العمق (ddPCA) ، والتي وصفوها بأنها "تجربة القوة الغاشمة". يوضح بن لينر ، أستاذ أبحاث ICREA ، منسق برنامج بيولوجيا الأنظمة في CRG ومؤلف الدراسة: "نحن نكسر الأشياء عن قصد بآلاف الطرق المختلفة لتشكيل صورة كاملة لكيفية عمل شيء ما". "يبدو الأمر كما لو كنت تشك في أن شمعة الإشعال تالفة ، ولكن بدلاً من مجرد التحقق من ذلك ، سيقوم الميكانيكي بتفكيك السيارة بأكملها وفحص جميع الأجزاء واحدة تلو الأخرى. من خلال تحليل عشرة آلاف شيء في وقت واحد ، نحدد جميع القطع المهمة حقًا ".
بعد ذلك ، نستخدم خوارزميات الذكاء الاصطناعي لتفسير نتائج المختبر.
تتمثل إحدى المزايا العظيمة للطريقة ، بالإضافة إلى تبسيط العملية اللازمة للعثور على مواقع allosteric ، في أنها تقنية ميسورة التكلفة ويمكن الوصول إليها لأي مختبر بحث في العالم. إنه يتطلب فقط الوصول إلى الكواشف الأساسية للبيولوجيا الجزيئية ، والوصول إلى مُسلسِل الحمض النووي وجهاز كمبيوتر. مع هذه المكونات الثلاثة ، يمكن لأي مختبر في غضون 2-3 أشهر ، بميزانية صغيرة ، إجراء هذه التجربة على البروتين الذي يريدونه ، كما تؤكد Júlia Domingo. يأمل الباحثون أن يستخدم علماؤنا هذه التقنية لرسم خريطة سريعة وشاملة للمواقع الخيفية للبروتينات البشرية واحدًا تلو الآخر. "إذا كانت لدينا بيانات كافية ، فربما في يوم من الأيام يمكننا المضي قدمًا والتنبؤ من تسلسل البروتين إلى الوظيفة. استخدم هذه البيانات لإرشادهم كعلاجات أفضل للتنبؤ بما إذا كان تغيير معين في البروتين سيتحول إلى مرض ”، استنتج الباحث.