![]() SLEDUJTE
SLEDUJTE
Nová inovatívna technika vyvinutá vedeckým tímom v Centre pre genomickú reguláciu (CRG) v Barcelone objavila existenciu množstva „diaľkových kontrol“, ktoré kontrolujú funkciu bielkovín a ktoré možno použiť ako ciele na dosiahnutie účinnejších liekov. a účinný pri rôznych patológiách, ako je demencia, rakovina a infekčné infekcie.
Tieto „diaľkové ovládače“ sú vedecky známe ako alosterické miesta. Ide o diaľkové ovládače, ktoré sú vzdialené od miesta pôsobenia proteínu, no majú kapacitu ho regulovať alebo modulovať“, Júlia Domingo, prvá spoluautorka štúdie, ktorá vychádza túto stredu v časopise „Nature“, vysvetlil pre ABC. A pridáva prirovnanie: „Akoby sa tým diaľkovým ovládaním dalo zapínať a vypínať žiarovku alebo regulovať intenzitu svetla.“
V tomto prípade, keď má v úmysle blokovať alebo regulovať aktivitu proteínov, ktoré si zachovávajú svoju zmenenú funkciu v obmedzenom priestore. Napríklad v prípade rakoviny majú proteíny, ktoré získali mutáciu, zmenenú funkčnosť, robia to abnormálne a bunka rastie nezvyčajne. V mnohých prípadoch neexistujú žiadne lieky, ktoré by mohli modulovať alebo blokovať túto abnormálnu aktivitu, alebo ak existujú, nie sú špecifické a uvoľňujú sa aj z iných proteínov, ktoré fungujú normálne.
Tradične, lovci drog navrhli liečby, ktoré sa zameriavajú na aktívne miesto proteínu, ktorého malá oblasť produkuje chemické reakcie, kde sa ciele viažu. Nevýhodou týchto liekov, známych ako ortosterické lieky, je to, že aktívne miesta mnohých proteínov sú veľmi podobné a lieky viažu a inhibujú mnoho rôznych proteínov súčasne, dokonca aj tie, ktoré fungujú normálne a nie sú zaujímavé na dotyk, čo môže spôsobiť vedľajšie účinky.
„Tam vstúpil do konceptu alosterie a potenciálu, ktorý má pri navrhovaní liekov. Zaujímavosťou alosterických miest je, že sú super špecifické pre každý proteín. Ak tieto alosterické miesta nájdu časť povrchu proteínu, kde môže liek pristáť, bude to mimoriadne špecifické pre daný proteín. Budeme môcť ašpirovať na účinnejšie lieky,“ zdôrazňuje výskumník.
„Nielenže sme zistili, že tieto terapeutické miesta sú hojné, ale existujú dôkazy, že sa s nimi dá manipulovať mnohými rôznymi spôsobmi. Namiesto toho, aby sme ich len zapínali a vypínali, môžeme modulovať ich činnosť ako termostat. Z inžinierskeho hľadiska je to, ako keby sme narazili na zlato, pretože nám to dáva veľa priestoru na navrhovanie „inteligentných liekov“, ktoré idú do zlého a preskakujú dobré,“ vysvetľuje André Faure, postdoktorandský výskumník v CRG. a prvý spoluautor článku.
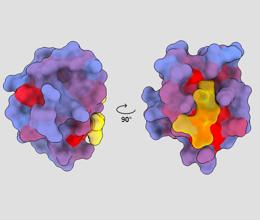 trojrozmerný obrázok zobrazujúci ľudský proteín PSD95-PDZ3 z rôznych uhlov pohľadu. Molekula sa viaže na aktívne miesto žltou farbou. Modrý až červený farebný gradient označuje možné alosterické miesta – André Faure/ChimeraX
trojrozmerný obrázok zobrazujúci ľudský proteín PSD95-PDZ3 z rôznych uhlov pohľadu. Molekula sa viaže na aktívne miesto žltou farbou. Modrý až červený farebný gradient označuje možné alosterické miesta – André Faure/ChimeraX
Na tento objav tím použil metódu, ktorá im umožňuje prijať proteínovú a systémovú formu a globálne stretnutie so všetkými miestami. Aby to urobili, vybrali dva veľmi bohaté proteíny v našom ľudskom proteóme. „50 % povrchu proteínu má alosterický potenciál. Naša metóda umožňuje vytvoriť atlas alosterických miest, čím by sa proces hľadania účinných liekov výrazne zefektívnil,“ ubezpečuje Júlia Domingo.
Autori štúdie vyvinuli techniku nazývanú double-depth PCA (ddPCA), ktorú opisujú ako „experiment hrubej sily“. "Úmyselne rozbíjame veci tisíckami rôznych spôsobov, aby sme si vytvorili úplný obraz o tom, ako niečo funguje," vysvetľuje profesor výskumu ICREA Ben Lehner, koordinátor programu systémovej biológie v CRG a autor štúdie. „Je to ako keby ste mali podozrenie, že zapaľovacia sviečka je zlá, ale namiesto toho, aby to len skontroloval, mechanik rozoberie celé auto a skontroluje všetky diely jeden po druhom. Analýzou desaťtisíc vecí naraz identifikujeme všetky časti, ktoré sú skutočne dôležité.“
Ďalej používame algoritmy umelej inteligencie na interpretáciu laboratórnych výsledkov.
Jednou z veľkých výhod metódy, okrem zjednodušenia procesu potrebného na nájdenie alosterických miest, je to, že ide o cenovo dostupnú a dostupnú techniku pre každé výskumné laboratórium na svete. „Vyžaduje si to prístup k základným molekulárnym biologickým činidlám, prístup k sekvenátoru DNA a počítaču. S týmito tromi komponentmi môže každé laboratórium za 2-3 mesiace s malým rozpočtom uskutočniť tento experiment s požadovaným proteínom,“ ubezpečuje Júlia Domingo. Vedci dúfajú, že naši vedci túto techniku využijú na rýchle a komplexné mapovanie alosterických miest ľudských proteínov jeden po druhom. „Ak budeme mať dostatok údajov, možno jedného dňa budeme môcť ísť o krok ďalej a predpovedať od sekvencie proteínov až po fungovanie. Použite tieto údaje, aby ste ich viedli ako lepšie terapie na predpovedanie, či sa určitá zmena v proteíne zvrhne na chorobu,“ uzavrel výskumník.
