![]() URMA
URMA
O nouă tehnică inovatoare dezvoltată de o echipă științifică de la Centrul de Reglementare Genomică (CRG) din Barcelona a descoperit existența unei multitudini de „comenzi de la distanță” care controlează funcția proteinelor și care pot fi folosite ca ținte pentru a obține medicamente mai eficiente. și eficient în diverse patologii precum demența, cancerul și infecțiile infecțioase.
Aceste „comenzi de la distanță” sunt cunoscute științific ca situri alosterice. Acestea sunt telecomenzi care sunt îndepărtate de locul de acțiune al proteinei, dar au capacitatea de a o regla sau de a o modula”, Júlia Domingo, primul co-autor al studiului, care este publicat miercuri în revista „Nature”. a explicat la ABC. Și adaugă o comparație: „Parcă cu acea telecomandă ai putea aprinde și stinge becul sau ai putea regla intensitatea luminii”.
În acest caz în care intenționează să blocheze sau să regleze activitatea proteinelor care își mențin funcția alterată în izolare. De exemplu, în cazul cancerului, proteinele care au dobândit o mutație au funcționalitatea alterată, o fac anormal și celula crește într-un mod neobișnuit. În multe cazuri, nu există medicamente care să moduleze sau să blocheze această activitate anormală sau, dacă există, nu sunt specifice și sunt eliberate și din alte proteine care funcționează normal.
În mod tradițional, vânătorii de droguri au conceput tratamente care vizează site-ul activ al unei proteine, a cărei regiune mică produce reacții chimice unde țintele se leagă. Dezavantajul acestor medicamente, cunoscute sub numele de medicamente ortosterice, este că situsurile active ale multor proteine sunt foarte asemănătoare, iar medicamentele au legat și inhibat multe proteine diferite în același timp, chiar și pe cele care funcționează normal și nu sunt interesante de atins, ceea ce poate provoca efecte secundare.
„Acolo a intrat în conceptul de alosterie și în potențialul pe care îl are pentru a proiecta medicamente. Lucrul interesant despre site-urile alosterice este că sunt super-specifice pentru fiecare proteină. Dacă aceste site-uri alosterice găsesc o parte din suprafața proteinei pe care medicamentul poate ateriza, va fi extrem de specific pentru proteina respectivă. Vom putea aspira la medicamente mai eficiente”, punctează cercetătorul.
„Nu numai că constatăm că aceste locuri terapeutice sunt abundente, dar există dovezi că pot fi manipulate în multe moduri diferite. În loc să le pornim și să le dezactivăm, le putem modula activitatea ca un termostat. Din punct de vedere ingineresc, este ca și cum am fi lovit de aur, pentru că ne oferă mult spațiu pentru a proiecta „droguri inteligente” care merg la rău și sar peste cele bune”, explică André Faure, cercetător postdoctoral la CRG. și primul coautor al articolului.
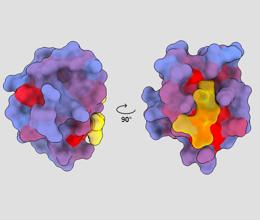 imagine tridimensională care arată proteina umană PSD95-PDZ3 din diferite puncte de vedere. O moleculă este prezentată legându-se de situsul activ în galben. Gradientul de culoare albastru spre roșu indică posibile situri alosterice – André Faure/ChimeraX
imagine tridimensională care arată proteina umană PSD95-PDZ3 din diferite puncte de vedere. O moleculă este prezentată legându-se de situsul activ în galben. Gradientul de culoare albastru spre roșu indică posibile situri alosterice – André Faure/ChimeraX
Pentru această descoperire, echipa a folosit o metodă care le permite să ia o proteină și o formă sistemică și o întâlnire globală cu toate site-urile. Pentru a face acest lucru, ei au ales două proteine foarte abundente în proteomul nostru uman. „50% din suprafața proteinei are potențial alosteric. Metoda noastră face posibilă realizarea unui atlas de situri alosterice, care ar eficientiza mult procesul de căutare a medicamentelor eficiente”, asigură Júlia Domingo.
Autorii studiului au dezvoltat o tehnică numită PCA cu adâncime dublă (ddPCA), pe care o descriu drept „experiment de forță brută”. „Sparăm lucrurile în mii de moduri diferite pentru a ne forma o imagine completă a modului în care funcționează ceva”, explică profesorul de cercetare ICREA Ben Lehner, coordonator al programului de biologie a sistemelor la CRG și autor al studiului. „Este ca și cum bănuiești că o bujie este proastă, dar în loc să verifice doar asta, mecanicul va demonta toată mașina și va verifica toate piesele una câte una. Analizând zece mii de lucruri deodată, identificăm toate piesele care sunt cu adevărat importante.”
În continuare, folosim algoritmi de inteligență artificială pentru a interpreta rezultatele de laborator.
Unul dintre marile avantaje ale metodei, pe lângă simplificarea procesului necesar găsirii siturilor alosterice, este că este o tehnică accesibilă și accesibilă pentru orice laborator de cercetare din lume. „Este nevoie doar de acces la reactivii de biologie moleculară de bază, acces la un secvențietor ADN și un computer. Cu aceste trei componente, orice laborator în 2-3 luni, cu un buget mic, poate realiza acest experiment pe proteina de interes pe care o doresc”, asigură Júlia Domingo. Speranța cercetătorilor este că oamenii de știință noștri vor folosi tehnica pentru a cartografi rapid și complet locurile alosterice ale proteinelor umane, unul câte unul. „Dacă avem suficiente date, poate într-o zi putem face un pas mai departe și putem prezice de la secvența proteinei la funcționare. Folosiți aceste date pentru a le ghida ca terapii mai bune pentru a prezice dacă o anumită modificare a unei proteine va degenera într-o boală”, a concluzionat cercetătorul.
