![]() VOLGEN
VOLGEN
Een nieuwe innovatieve techniek ontwikkeld door een wetenschappelijk team van het Centre for Genomic Regulation (CRG) in Barcelona heeft het bestaan ontdekt van een groot aantal 'afstandsbedieningen' die de functie van eiwitten regelen en die kunnen worden gebruikt als doelwitten om effectievere medicijnen te bereiken en efficiënt in verschillende pathologieën zoals dementie, kanker en infectieuze infecties.
Deze 'afstandsbedieningen' zijn wetenschappelijk bekend als allosterische sites. Dit zijn afstandsbedieningen die ver verwijderd zijn van de plaats van actie van het eiwit, maar het vermogen hebben om het te reguleren of te moduleren", Júlia Domingo, eerste co-auteur van de studie, die deze woensdag wordt gepubliceerd in het tijdschrift "Nature", uitgelegd aan ABC. En hij voegt een vergelijking toe: "Het is alsof je met die afstandsbediening de lamp aan en uit kunt zetten of de intensiteit van het licht kunt regelen."
In dit geval waar het de activiteit wil blokkeren of reguleren van eiwitten die hun veranderde functie in opsluiting behouden. In het geval van kanker bijvoorbeeld, is de functionaliteit van de eiwitten die een mutatie hebben gekregen veranderd, ze doen dit abnormaal en de cel groeit ongewoon. In veel gevallen zijn er geen medicijnen die deze abnormale activiteit kunnen moduleren of blokkeren, of, als die er zijn, zijn ze niet specifiek en worden ze ook afgegeven door andere eiwitten die normaal functioneren.
Traditioneel hebben drugsjagers behandelingen ontworpen die zich richten op de actieve plaats van een eiwit, waarvan het kleine gebied chemische reacties veroorzaakt waar doelen zich binden. Het nadeel van deze medicijnen, bekend als orthosterische medicijnen, is dat de actieve plaatsen van veel eiwitten erg op elkaar lijken en dat de medicijnen veel verschillende eiwitten tegelijkertijd hebben gebonden en geremd, zelfs degenen die normaal functioneren en niet interessant zijn om aan te raken. bijwerkingen kunnen veroorzaken.
“Daar betrad hij het concept van allosterie en het potentieel dat het heeft om medicijnen te ontwerpen. Het interessante van allosterische sites is dat ze superspecifiek zijn voor elk eiwit. Als deze allosterische plaatsen een deel van het eiwitoppervlak vinden waar het medicijn kan landen, zal het extreem specifiek zijn voor dat eiwit. We kunnen dan streven naar effectievere medicijnen”, stelt de onderzoeker.
“We vinden niet alleen dat deze therapeutische plaatsen in overvloed aanwezig zijn, maar er is ook bewijs dat ze op veel verschillende manieren kunnen worden gemanipuleerd. In plaats van ze alleen maar aan en uit te zetten, kunnen we hun activiteit moduleren als een thermostaat. Vanuit technisch oogpunt is het alsof we goud hebben gevonden, want het geeft ons veel ruimte om 'smart drugs' te ontwerpen die ten kwade gaan en de goede overslaan", legt André Faure, postdoctoraal onderzoeker bij het CRG uit. en eerste co-auteur van het artikel.
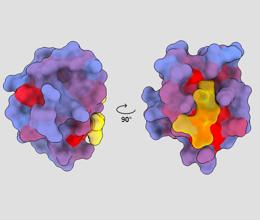 driedimensionale afbeelding die het menselijke eiwit PSD95-PDZ3 vanuit verschillende gezichtspunten toont. Een molecuul wordt getoond binden aan de actieve plaats in het geel. Blauw naar rood kleurverloop geeft mogelijke allosterische sites aan - André Faure/ChimeraX
driedimensionale afbeelding die het menselijke eiwit PSD95-PDZ3 vanuit verschillende gezichtspunten toont. Een molecuul wordt getoond binden aan de actieve plaats in het geel. Blauw naar rood kleurverloop geeft mogelijke allosterische sites aan - André Faure/ChimeraX
Voor deze ontdekking heeft het team een methode gebruikt waarmee ze een eiwit en een systemische vorm kunnen aannemen en een wereldwijde ontmoeting met alle sites. Om dit te doen, hebben ze twee zeer overvloedige eiwitten gekozen in ons menselijke proteoom. “50% van het eiwitoppervlak heeft allosterisch potentieel. Onze methode maakt het mogelijk om een atlas van allosterische sites te maken, wat het zoeken naar effectieve medicijnen veel efficiënter zou maken”, verzekert Júlia Domingo.
De auteurs van het onderzoek ontwikkelden een techniek genaamd double-depth PCA (ddPCA), die ze omschrijven als een 'brute force-experiment'. "We breken dingen met opzet op duizenden verschillende manieren om een compleet beeld te krijgen van hoe iets werkt", legt ICREA-onderzoeksprofessor Ben Lehner, coördinator van het programma Systeembiologie van het CRG en auteur van het onderzoek, uit. “Het is alsof je vermoedt dat een bougie defect is, maar in plaats van dat alleen te controleren, haalt de monteur de hele auto uit elkaar en controleert alle onderdelen één voor één. Door tienduizend dingen tegelijk te analyseren, identificeren we alle stukjes die echt belangrijk zijn.”
Vervolgens gebruiken we kunstmatige intelligentie-algoritmen om de laboratoriumresultaten te interpreteren.
Een van de grote voordelen van de methode, naast het vereenvoudigen van het proces dat nodig is om allosterische sites te vinden, is dat het een betaalbare en toegankelijke techniek is voor elk onderzoekslaboratorium ter wereld. "Het vereist alleen toegang tot elementaire moleculaire biologiereagentia, toegang tot een DNA-sequencer en een computer. Met deze drie componenten kan elk laboratorium in 2-3 maanden, met een klein budget, dit experiment uitvoeren op het gewenste eiwit”, verzekert Júlia Domingo. De onderzoekers hopen dat onze wetenschappers de techniek zullen gebruiken om snel en uitgebreid de allosterische plaatsen van menselijke eiwitten één voor één in kaart te brengen. “Als we genoeg gegevens hebben, kunnen we op een dag misschien een stap verder gaan en voorspellen van eiwitsequentie tot functie. Gebruik deze gegevens om ze te begeleiden als betere therapieën om te voorspellen of een bepaalde verandering in een eiwit gaat degenereren tot een ziekte”, besluit de onderzoeker.
