![]() TURPMĀK
TURPMĀK
Jauna novatoriska tehnika, ko izstrādājusi zinātniskā grupa Genomikas regulēšanas centrā (CRG) Barselonā, ir atklājusi daudzu “tālvadības pulšu” esamību, kas kontrolē proteīnu darbību un ko var izmantot kā mērķi efektīvāku zāļu iegūšanai. un efektīvs dažādu patoloģiju, piemēram, demences, vēža un infekcijas infekciju gadījumā.
Šīs “tālvadības pultis” ir zinātniski pazīstamas kā alosteriskās vietas. Tās ir tālvadības pultis, kas atrodas tālu no proteīna iedarbības vietas, bet spēj to regulēt vai modulēt," Jūlija Domingo, pētījuma pirmā līdzautore, kas šo trešdien publicēts žurnālā "Nature". paskaidroja ABC. Un viņš piebilst līdzību: "It kā ar to tālvadības pulti varētu ieslēgt un izslēgt spuldzi vai regulēt gaismas intensitāti."
Šajā gadījumā, ja tas paredz bloķēt vai regulēt proteīnu aktivitāti, kas saglabā savu mainīto funkciju norobežojumā. Piemēram, vēža gadījumā proteīniem, kas ieguvuši mutāciju, tiek mainīta funkcionalitāte, tie to dara neparasti un šūna aug neparasti. Daudzos gadījumos nav zāļu, kas varētu modulēt vai bloķēt šo neparasto aktivitāti, vai, ja ir, tās nav specifiskas un tiek atbrīvotas arī no citiem normāli funkcionējošiem proteīniem.
Tradicionāli narkotiku mednieki ir izstrādājuši ārstēšanas metodes, kas vērstas uz proteīna aktīvo vietu, kuras nelielais reģions rada ķīmiskas reakcijas, kur mērķi saistās. Šo zāļu, kas pazīstamas kā ortosteriskās zāles, trūkums ir tāds, ka daudzu proteīnu aktīvās vietas ir ļoti līdzīgas un zāles vienlaikus ir saistījušas un inhibējušas daudzas dažādas olbaltumvielas, pat tās, kas darbojas normāli un kurām nav interesanti pieskarties. var izraisīt blakusparādības.
"Tur viņš ieviesa allosterijas jēdzienu un potenciālu, kas tai piemīt narkotiku izstrādē. Interesantā lieta par allosteriskajām vietām ir tā, ka tās ir īpaši specifiskas katram proteīnam. Ja šīs allosteriskās vietas atrod daļu no proteīna virsmas, kur zāles var nolaisties, tas būs ārkārtīgi specifisks šim proteīnam. Varēsim tiekties pēc efektīvākiem medikamentiem,” norāda pētniece.
"Mēs ne tikai atklājam, ka šīs terapeitiskās vietas ir daudz, bet ir pierādījumi, ka ar tām var manipulēt dažādos veidos. Tā vietā, lai tos vienkārši ieslēgtu un izslēgtu, mēs varam modulēt to darbību kā termostatu. No inženierzinātņu viedokļa šķiet, ka mēs esam ieguvuši zeltu, jo tas dod mums daudz vietas, lai izstrādātu "viedās zāles", kas iet uz slikto un izlaiž labo," skaidro CRG pēcdoktorantūras pētnieks Andrē Forē. un pirmais līdzautors rakstam.
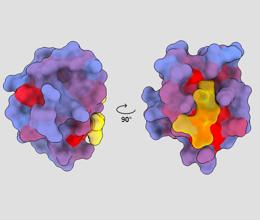 trīsdimensiju attēls, kas parāda cilvēka proteīnu PSD95-PDZ3 no dažādiem skatu punktiem. Molekula saistās ar aktīvo vietu dzeltenā krāsā. Zilas līdz sarkanas krāsas gradients norāda uz iespējamām allosteriskām vietām – André Faure/ChimeraX
trīsdimensiju attēls, kas parāda cilvēka proteīnu PSD95-PDZ3 no dažādiem skatu punktiem. Molekula saistās ar aktīvo vietu dzeltenā krāsā. Zilas līdz sarkanas krāsas gradients norāda uz iespējamām allosteriskām vietām – André Faure/ChimeraX
Šim atklājumam komanda ir izmantojusi metodi, kas ļauj iegūt proteīnu un sistēmisku formu un globālu tikšanos ar visām vietnēm. Lai to izdarītu, viņi ir izvēlējušies divus ļoti bagātīgus proteīnus mūsu cilvēka proteomā. "50% proteīna virsmas ir allosteriskais potenciāls. Mūsu metode ļauj izveidot alosterisko vietu atlantu, kas padarītu efektīvāku zāļu meklēšanas procesu daudz efektīvāku,” apliecina Jūlija Domingo.
Pētījuma autori izstrādāja paņēmienu, ko sauc par dubultā dziļuma PCA (ddPCA), ko viņi raksturo kā "brutāla spēka eksperimentu". "Mēs apzināti sadalām lietas tūkstošiem dažādu veidu, lai izveidotu pilnīgu priekšstatu par to, kā kaut kas darbojas," skaidro ICREA pētniecības profesors Bens Lehners, CRG Sistēmu bioloģijas programmas koordinators un pētījuma autors. “Tas ir tāpat kā tad, ja jums ir aizdomas, ka aizdedzes svece ir slikta, taču tā vietā, lai to vienkārši pārbaudītu, mehāniķis izjauks visu automašīnu un pārbaudīs visas detaļas pa vienam. Analizējot desmit tūkstošus lietu vienlaikus, mēs identificējam visas patiesi svarīgās daļas.
Tālāk mēs izmantojam mākslīgā intelekta algoritmus, lai interpretētu laboratorijas rezultātus.
Viena no metodes lielajām priekšrocībām, papildus procesa vienkāršošanai, kas nepieciešams, lai atrastu allosteriskās vietas, ir tā, ka tā ir pieņemama un pieejama metode jebkurai pētniecības laboratorijai pasaulē. "Tam vienkārši nepieciešama piekļuve pamata molekulārās bioloģijas reaģentiem, piekļuve DNS sekvencēram un datoram. Izmantojot šos trīs komponentus, jebkura laboratorija 2–3 mēnešos ar nelielu budžetu var veikt šo eksperimentu ar interesējošo proteīnu, ko tā vēlas,” apliecina Jūlija Domingo. Pētnieki cer, ka mūsu zinātnieki izmantos šo metodi, lai ātri un visaptveroši kartētu cilvēka proteīnu allosteriskās vietas pa vienam. "Ja mums ir pietiekami daudz datu, iespējams, kādu dienu mēs varam iet vienu soli tālāk un prognozēt no olbaltumvielu secības līdz funkcijai. Izmantojiet šos datus, lai vadītu tos kā labākas terapijas, lai prognozētu, vai noteiktas proteīna izmaiņas pāraugs par slimību," secināja pētnieks.