![]() FYLGJA
FYLGJA
Ný nýstárleg tækni þróuð af vísindateymi við Centre for Genomic Regulation (CRG) í Barcelona hefur uppgötvað tilvist fjölda „fjarstýringa“ sem stjórna virkni próteina og sem hægt er að nota sem skotmörk til að ná fram skilvirkari lyfjum. og skilvirk í ýmsum meinafræði eins og vitglöpum, krabbameini og smitsýkingum.
Þessar „fjarstýringar“ eru vísindalega þekktar sem allosteric sites. Þetta eru fjarstýringar sem eru fjarlægar verkunarstað próteinsins, en hafa getu til að stýra því eða móta það,“ Júlia Domingo, fyrsti meðhöfundur rannsóknarinnar, sem birtist á miðvikudaginn í tímaritinu „Nature“. útskýrði fyrir ABC. Og hann bætir við líkingu: "Það er eins og með þessari fjarstýringu væri hægt að kveikja og slökkva á perunni eða stilla ljósstyrkinn."
Í þessu tilviki þar sem það ætlar að hindra eða stjórna virkni próteina sem viðhalda breyttri virkni þeirra í innilokun. Til dæmis, ef um krabbamein er að ræða, er virkni þeirra breytt, þau gera það óeðlilega og fruman vex óvenjulega. Í mörgum tilfellum eru engin lyf sem geta stillt eða hindrað þessa óeðlilegu virkni eða, ef svo er, eru þau ekki sértæk og losna einnig úr öðrum próteinum sem virka eðlilega.
Hefð er fyrir því að fíkniefnaveiðarar hafa hannað meðferðir sem miða að virkum stað próteins, en lítið svæði þess framkallar efnahvörf þar sem skotmörk bindast. Gallinn við þessi lyf, sem kallast réttstöðulyf, er að virkir staðir margra próteina eru mjög líkir og lyfin hafa bundið og hamlað mörg mismunandi prótein á sama tíma, jafnvel þau sem virka eðlilega og ekki er áhugavert að snerta, sem getur valdið aukaverkunum.
„Þar kom hann inn í hugtakið allosteria og möguleikana sem það hefur til að hanna lyf. Það áhugaverða við allósterískar síður er að þær eru mjög sértækar fyrir hvert prótein. Ef þessir allósterísku staðir finna hluta próteinyfirborðsins þar sem lyfið getur lent, mun það vera mjög sértækt fyrir það prótein. Við munum geta stefnt að skilvirkari lyfjum,“ bendir rannsakandinn á.
„Við komumst ekki aðeins að því að þessi meðferðarstaðir eru í miklu magni, heldur eru vísbendingar um að hægt sé að vinna með þá á marga mismunandi vegu. Í stað þess að kveikja og slökkva á þeim, getum við stillt virkni þeirra eins og hitastillir. Frá verkfræðilegu sjónarhorni er eins og við höfum slegið gull, því það gefur okkur mikið svigrúm til að hanna „snjöll lyf“ sem fara til hins illa og sleppa því góða,“ útskýrir André Faure, nýdoktor við CRG. og fyrsti meðhöfundur greinarinnar.
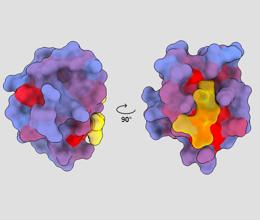 þrívíddarmynd sem sýnir próteinið PSD95-PDZ3 úr mönnum frá mismunandi sjónarhornum. Sýnt er að sameind bindist virka staðnum í gulu. Blár yfir í rauður litahalli gefur til kynna mögulegar allósterískir staðir – André Faure/ChimeraX
þrívíddarmynd sem sýnir próteinið PSD95-PDZ3 úr mönnum frá mismunandi sjónarhornum. Sýnt er að sameind bindist virka staðnum í gulu. Blár yfir í rauður litahalli gefur til kynna mögulegar allósterískir staðir – André Faure/ChimeraX
Fyrir þessa uppgötvun hefur teymið notað aðferð sem gerir þeim kleift að taka prótein og kerfisbundið form og alþjóðlega fundi með öllum vefsvæðum. Til að gera þetta hafa þeir valið tvö mjög mikið prótein í próteininu okkar. „50% af próteinyfirborðinu hefur allosteric möguleika. Aðferðin okkar gerir það mögulegt að búa til atlas yfir allósterískar síður, sem myndi gera ferlið við að leita að áhrifaríkum lyfjum mun skilvirkara,“ fullvissar Júlia Domingo.
Höfundar rannsóknarinnar þróuðu tækni sem kallast tvöfaldur dýpi PCA (ddPCA), sem þeir lýsa sem „grimmdarkraftatilraun“. „Við brjótum hlutina viljandi á þúsundir mismunandi leiða til að mynda heildarmynd af því hvernig eitthvað virkar,“ útskýrir ICREA rannsóknarprófessor Ben Lehner, umsjónarmaður kerfislíffræðinámsins við CRG og höfundur rannsóknarinnar. „Þetta er eins og ef þig grunar að kerti sé slæmt, en í stað þess að athuga það, mun vélvirki taka allan bílinn í sundur og skoða alla hlutana einn í einu. Með því að greina tíu þúsund hluti í einu greinum við öll þau verk sem eru virkilega mikilvæg.“
Næst notum við gervigreindaralgrím til að túlka niðurstöður rannsóknarstofunnar.
Einn af stóru kostum aðferðarinnar, auk þess að einfalda ferlið sem er nauðsynlegt til að finna allosteric staði, er að það er hagkvæm og aðgengileg tækni fyrir hvaða rannsóknarstofu í heiminum sem er. „Það þarf bara aðgang að grunnvirkum sameindalíffræði, aðgang að DNA raðgreiningartæki og tölvu. Með þessum þremur íhlutum getur hvaða rannsóknarstofa sem er á 2-3 mánuðum, með litlum fjárveitingum, framkvæmt þessa tilraun á próteininu sem hún vill,“ fullvissar Júlia Domingo. Von rannsakenda er að vísindamenn okkar muni nota tæknina til að kortleggja á skjótan og yfirgripsmikinn hátt ósamsetta staði próteina manna, eitt af öðru. „Ef við höfum næg gögn gætum við kannski einn daginn gengið skrefinu lengra og spáð fyrir um próteinröð til virkni. Notaðu þessi gögn til að leiðbeina þeim sem betri meðferð til að spá fyrir um hvort ákveðin breyting á próteini muni hrörna í sjúkdóm,“ sagði rannsakandinn að lokum.
