![]() SLIJEDITI
SLIJEDITI
Nova inovativna tehnika koju je razvio znanstveni tim u Centru za genomsku regulaciju (CRG) u Barceloni otkrila je postojanje mnoštva 'daljinskih upravljača' koji kontroliraju funkciju proteina i koji se mogu koristiti kao mete za postizanje učinkovitijih lijekova i učinkovit u raznim patologijama kao što su demencija, rak i zarazne infekcije.
Ti 'daljinski upravljači' znanstveno su poznati kao alosterična mjesta. To su daljinski upravljači koji su udaljeni od mjesta djelovanja proteina, ali imaju sposobnost da ga reguliraju ili moduliraju", Júlia Domingo, prva koautorica studije, koja je objavljena ove srijede u časopisu "Nature", objasnio je za ABC. I dodaje usporedbu: "Kao da s tim daljinskim upravljačem možete paliti i gasiti žarulju ili regulirati intenzitet svjetla."
U ovom slučaju kada namjerava blokirati ili regulirati aktivnost proteina koji održavaju svoju promijenjenu funkciju u zatvorenom prostoru. Na primjer, u slučaju raka, proteini koji su dobili mutaciju imaju promijenjenu funkcionalnost, čine to abnormalno i stanica raste neuobičajeno. U mnogim slučajevima ne postoje lijekovi koji mogu modulirati ili blokirati ovu abnormalnu aktivnost ili, ako postoje, nisu specifični i također se oslobađaju iz drugih proteina koji normalno funkcioniraju.
Tradicionalno, lovci na droge osmislili su tretmane koji ciljaju na aktivno mjesto proteina, čija mala regija proizvodi kemijske reakcije gdje se mete vežu. Nedostatak ovih lijekova, poznatih kao ortosterični lijekovi, je taj što su aktivna mjesta mnogih proteina vrlo slična i lijekovi su vezali i inhibirali mnoge različite proteine u isto vrijeme, čak i one koji normalno funkcioniraju i nisu zanimljivi za dodir, koji može izazvati nuspojave.
“Tamo je ušao u koncept alosterije i potencijala koji ima za dizajniranje lijekova. Zanimljivost alosteričnih mjesta je da su super specifična za svaki protein. Ako ova alosterična mjesta pronađu dio površine proteina gdje lijek može sletjeti, bit će izrazito specifičan za taj protein. Moći ćemo težiti učinkovitijim lijekovima”, ističe istraživač.
“Ne samo da otkrivamo da su ova terapijska mjesta u izobilju, već postoje dokazi da se njima može manipulirati na mnogo različitih načina. Umjesto da ih samo uključujemo i isključujemo, možemo modulirati njihovu aktivnost poput termostata. S inženjerske točke gledišta, kao da smo zapalili zlato, jer nam to daje puno prostora da osmislimo 'pametne lijekove' koji idu u loše, a preskaču dobro", objašnjava André Faure, postdoktorski istraživač na CRG-u. i prvi suautor članka.
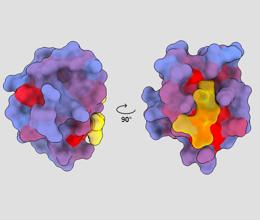 trodimenzionalna slika koja prikazuje ljudski protein PSD95-PDZ3 s različitih stajališta. Žutom je bojom prikazana molekula koja se veže na aktivno mjesto. Gradijent plave prema crvenoj boji ukazuje na moguća alosterična mjesta – André Faure/ChimeraX
trodimenzionalna slika koja prikazuje ljudski protein PSD95-PDZ3 s različitih stajališta. Žutom je bojom prikazana molekula koja se veže na aktivno mjesto. Gradijent plave prema crvenoj boji ukazuje na moguća alosterična mjesta – André Faure/ChimeraX
Za ovo otkriće, tim je upotrijebio metodu koja im omogućuje da uzmu protein i sistemski oblik i globalni susret sa svim mjestima. Da bi to učinili, odabrali su dva vrlo bogata proteina u našem ljudskom proteomu. “50% površine proteina ima alosterički potencijal. Naša metoda omogućuje izradu atlasa alosteričnih mjesta, čime bi proces traženja učinkovitih lijekova bio mnogo učinkovitiji”, uvjerava Júlia Domingo.
Autori studije razvili su tehniku nazvanu PCA dvostruke dubine (ddPCA), koju opisuju kao "eksperiment grube sile". "Namjerno razbijamo stvari na tisuće različitih načina kako bismo stvorili potpunu sliku o tome kako nešto funkcionira", objašnjava ICREA istraživački profesor Ben Lehner, koordinator programa za biologiju sustava na CRG-u i autor studije. “To je kao da sumnjate da je svjećica loša, ali umjesto da to samo provjeri, mehaničar će rastaviti cijeli auto i provjeriti sve dijelove jedan po jedan. Analizirajući deset tisuća stvari odjednom, identificiramo sve dijelove koji su zaista važni.”
Zatim koristimo algoritme umjetne inteligencije za tumačenje laboratorijskih rezultata.
Jedna od velikih prednosti metode, osim što pojednostavljuje proces potrebno za pronalaženje alosteričnih mjesta, jest to što je pristupačna i pristupačna tehnika za bilo koji istraživački laboratorij u svijetu. “Zahtijeva samo pristup osnovnim reagensima molekularne biologije, pristup DNA sekvenceru i računalu. S ove tri komponente svaki laboratorij za 2-3 mjeseca, uz mali proračun, može izvesti ovaj eksperiment na proteinu od interesa koji želi”, uvjerava Júlia Domingo. Istraživači se nadaju da će naši znanstvenici koristiti tehniku za brzo i sveobuhvatno mapiranje alosteričnih mjesta ljudskih proteina jedno po jedno. “Ako imamo dovoljno podataka, možda jednog dana možemo otići korak dalje i predvidjeti od slijeda proteina do funkcije. Koristite ove podatke da ih vodite kao bolje terapije za predviđanje hoće li se određena promjena u proteinu degenerirati u bolest”, zaključio je istraživač.
