![]() ПОСЛЕДВАМ
ПОСЛЕДВАМ
Нова иновативна техника, разработена от научен екип в Центъра за геномна регулация (CRG) в Барселона, откри съществуването на множество „дистанционни управления“, които контролират функцията на протеините и които могат да се използват като цели за постигане на по-ефективни лекарства и е ефективен при различни патологии като деменция, рак и инфекциозни инфекции.
Тези „дистанционни управления“ са научно известни като алостерични места. Това са дистанционни управления, които са отдалечени от мястото на действие на протеина, но имат способността да го регулират или модулират“, Джулия Доминго, първи съавтор на изследването, което е публикувано тази сряда в списание „Nature“, обясни пред ABC. И добавя едно сравнение: „Сякаш с това дистанционно управление можеш да включваш и изключваш крушката или да регулираш интензитета на светлината“.
В този случай, когато възнамерява да блокира или регулира активността на протеините, които поддържат променената си функция в затворено пространство. Например, в случай на рак, протеините, които са придобили мутация, имат променена функционалност, правят това необичайно и клетката расте по необичаен начин. В много случаи няма лекарства, които да модулират или блокират тази анормална активност или, ако има, те не са специфични и също се освобождават от други протеини, които функционират нормално.
Традиционно ловците на наркотици са проектирали лечения, които са насочени към активния център на протеин, чийто малък регион произвежда химични реакции, където целите се свързват. Недостатъкът на тези лекарства, известни като ортостерични лекарства, е, че активните места на много протеини са много сходни и лекарствата са свързвали и инхибирали много различни протеини едновременно, дори тези, които функционират нормално и не са интересни за докосване, които може да предизвика странични ефекти.
„Там той навлезе в концепцията за алостерията и потенциала, който има за проектиране на лекарства. Интересното при алостеричните сайтове е, че те са супер специфични за всеки протеин. Ако тези алостерични места намерят част от повърхността на протеина, където лекарството може да попадне, то ще бъде изключително специфично за този протеин. Ще можем да се стремим към по-ефективни лекарства”, посочва изследователят.
„Не само откриваме, че тези терапевтични места са в изобилие, но има доказателства, че те могат да бъдат манипулирани по много различни начини. Вместо просто да ги включваме и изключваме, можем да модулираме тяхната активност като термостат. От инженерна гледна точка, сякаш сме постигнали злато, защото това ни дава много място да проектираме „умни лекарства“, които отиват към лошото и прескачат доброто“, обяснява Андре Форе, постдокторант в CRG. и първи съавтор на статията.
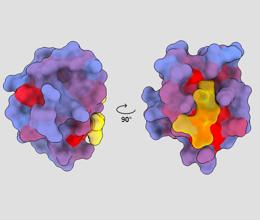 триизмерно изображение, показващо човешкия протеин PSD95-PDZ3 от различни гледни точки. Молекула е показана, свързваща се с активното място в жълто. Градиентът на синия към червения цвят показва възможни алостерични места – André Faure/ChimeraX
триизмерно изображение, показващо човешкия протеин PSD95-PDZ3 от различни гледни точки. Молекула е показана, свързваща се с активното място в жълто. Градиентът на синия към червения цвят показва възможни алостерични места – André Faure/ChimeraX
За това откритие екипът е използвал метод, който им позволява да приемат протеин и системна форма и глобална среща с всички сайтове. За да направят това, те са избрали два много изобилни протеина в нашия човешки протеом. „50% от повърхността на протеина има алостеричен потенциал. Нашият метод дава възможност да се направи атлас от алостерични места, което би направило процеса на търсене на ефективни лекарства много по-ефективен”, уверява Джулия Доминго.
Авторите на изследването разработиха техника, наречена PCA с двойна дълбочина (ddPCA), която те описват като „експеримент с груба сила“. „Ние нарочно разбиваме нещата по хиляди различни начини, за да формираме пълна картина за това как работи нещо“, обяснява професорът по изследване на ICREA Бен Ленер, координатор на програмата по системна биология в CRG и автор на изследването. „Това е като ако подозирате, че запалителната свещ е лоша, но вместо просто да провери това, механикът ще разглоби цялата кола и ще провери всички части една по една. Анализирайки десет хиляди неща наведнъж, ние идентифицираме всички части, които са наистина важни.”
След това използваме алгоритми за изкуствен интелект, за да интерпретираме лабораторните резултати.
Едно от големите предимства на метода, в допълнение към опростяването на процеса, необходим за намиране на алостерични места, е, че той е достъпна и достъпна техника за всяка изследователска лаборатория в света. „Това просто изисква достъп до основни реагенти за молекулярна биология, достъп до ДНК секвенсер и компютър. С тези три компонента всяка лаборатория за 2-3 месеца, с малък бюджет, може да проведе този експеримент върху протеина, който иска“, уверява Джулия Доминго. Надеждата на изследователите е, че нашите учени ще използват техниката за бързо и изчерпателно картографиране на алостеричните места на човешки протеини един по един. „Ако имаме достатъчно данни, може би един ден можем да отидем една крачка по-далеч и да предвидим от протеинова последователност до функция. Използвайте тези данни, за да ги насочите като по-добри терапии, за да предскажете дали определена промяна в протеина ще се изроди в заболяване“, заключи изследователят.
